Quy trình chuẩn bị ARN cho phân tích gồm 4 bước chính:
Bước 1: Thu thập và bảo quản mẫu
Bước 2: Tách chiết ARN
Bước 3: Định lượng ARN tách được
Bước 4: Bảo quản ARN sau khi tách
1. Thu thập và bảo quản mẫu

Tìm kiếm phương pháp phù hợp nhất để phá vỡ tế bào hoặc mô là điều vô cùng quan trọng để thu được lượng ARN có sản lượng và chất lượng tốt nhất. Trong quá trình phá vỡ mẫu để tách ARN, hóa chất ly giải và chất biến tính rất quan trọng vì nó có ảnh hưởng tới thành phần tế bào ở tại thời điểm mà tế bào bị phá vỡ. Đây có thể là vấn đề nếu các mô và tế bào khó phá vỡ (ví dụ như xương), khi chúng chứa vỏ hoặc thành (ví dụ: nấm men, vi khuẩn gram âm bào tử). Đối mặt với vấn đề này, có một dung dịch thường được sử dụng để làm đóng băng các mô/ tế bào là nito lỏng hoặc đá khô. Các mẫu bị đông lạnh sau đó sẽ được xử lý để chọn khối lượng mong muốn hoặc để nghiền mẫu trước khi biến tính.
2. Tách chiết ARN
Các quy trình áp dụng trong tách chiết ARN có thể phân loại thành bốn nhóm kỹ thuật cơ bản: phương pháp tách chiết hữu cơ (organic extraction methods), phương pháp ly tâm (spin basket formats), phương pháp sử dụng hạt từ (magnetic particle methods) và phương pháp ly giải trực tiếp (direct lysis methods). Tất cả những phương pháp này cho phép chúng ta tách chiết được ARN chất lượng cao sử dụng cho nhiều kỹ thuật phân tích. Tuy nhiên, tồn tại một vài vấn đề cần lưu ý để có thể lựa chọn công nghệ tinh sạch phù hợp nhất.
Mẫu vật nào khó xử lý?
Mô chứa các enzyme nucleases hoặc các mô mỡ, mô chứa nhiều chất ức chế có thể dẫn đến nhiều vấn đề.
Cần bao nhiêu mẫu cho cả quá trình?
Kích thước mẫu lớn đồng nghĩa với các kit cần lượng hóa chất nhiều. Nhìn chung, mẫu càng lớn, thông lượng càng không chính xác.
a) Phương pháp tách chiết hữu cơ
Phương pháp tách chiết hữu cơ được coi là tiêu chuẩn vàng trong việc tách chiết ARN. Suốt quá trình, mẫu được làm đồng nhất trong dung môi chứa phenol và sau đó được ly tâm. Trong quá trình ly tâm, mẫu sẽ phân tách thành ba pha: pha hữu cơ dưới cùng (organic phase), pha protein bị biến tính và ADN tổng số (gDNA) nằm ở giữa (Interphase) và pha trên cùng chứa nước và ARN (Aqueous phase- pha lỏng). Sau đó, tiến hành thu lấy pha trên cùng và ARN được thu hồi bằng phương pháp tủa alcohol và tái hydrate hóa (rehydration – thêm nước vào tủa).

Nguồn ảnh: https://upload.wikimedia.org
- Ưu điểm của phương pháp
- Nhược điểm của phương pháp
b) Phương pháp ly tâm, sử dụng màng lọc
Phương pháp này sử dụng màng (thường là sợi thủy tinh, derivitized silica hoặc màng trao đổi ion) đặt dưới đáy một ống nhựa nhỏ. Mẫu được ly giải trong đệm chứa chất ức chế RNase (ví dụ các muối guanidine), các acid nucleic bám với màng nhờ sử dụng lực ly tâm vượt qua các sản phẩm của quá trình ly giải. Sau đó, dùng dung dịch rửa làm sạch màng. Một dung dịch rửa giải phù hợp được thêm vào và tiến hành ly tâm để thu mẫu. Một vài phương pháp có thể sử dụng máy ly tâm hoặc hệ thống chân không. Ngoài ra, phương pháp lai (hybrid) kết hợp hiệu quả của phương pháp tách chiết hữu cơ với sự đơn giản trong thu mẫu, rửa loại các chất không cần thiết, rửa giải của phương pháp ly tâm cũng đang được nhiều phòng thí nghiệm áp dụng.
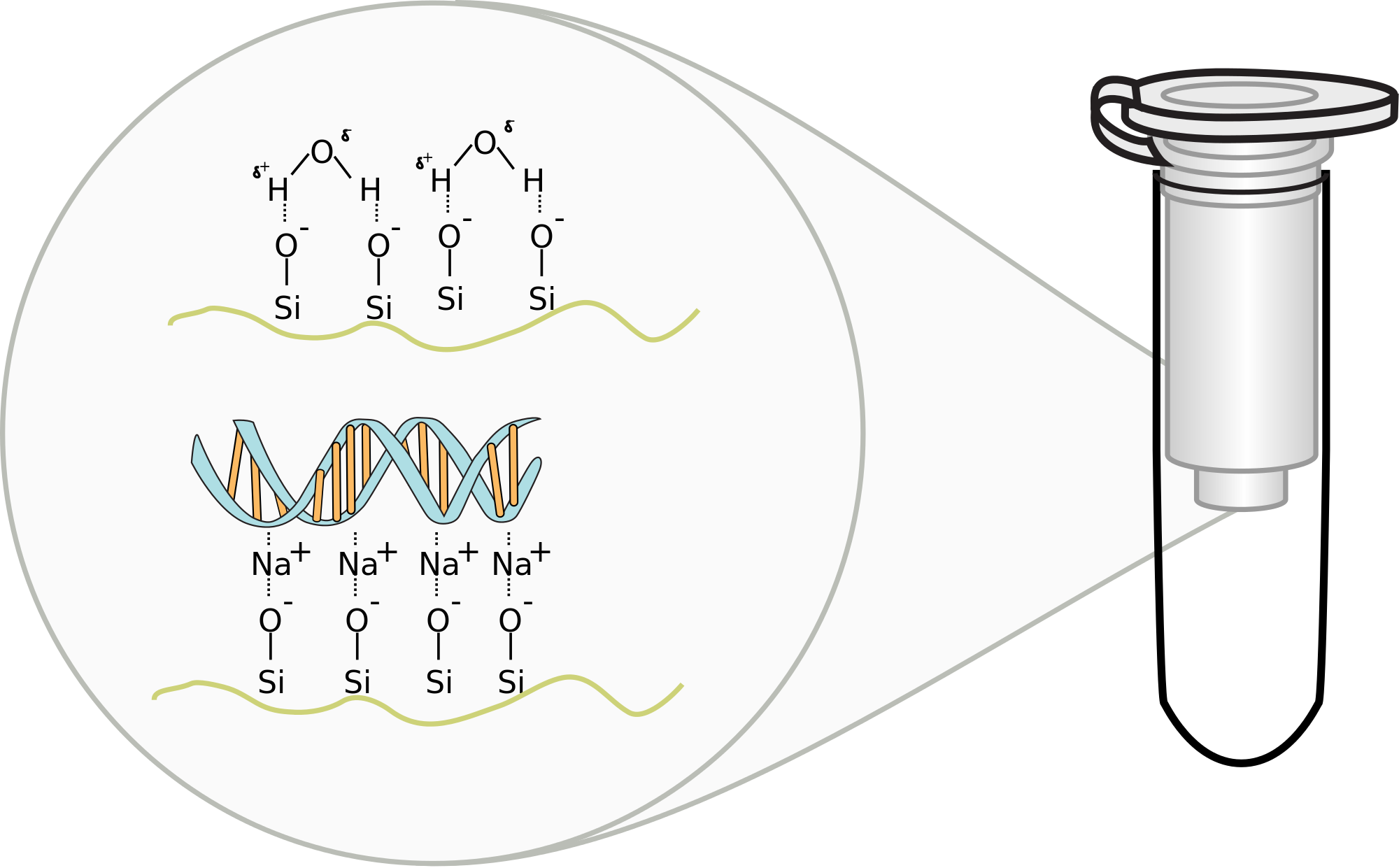
Nguồn ảnh: https://upload.wikimedia.org
- Ưu điểm
- Nhược điểm
c) Phương pháp sử dụng hạt từ
Phương pháp hạt từ sử dụng các hạt nhỏ (kích thước 0.5 – 1 µm), chứa lõi thuận từ và vỏ được thiết kế có khả năng gắn với vật chất quan tâm (vật chất đích). Hạt thuận từ di chuyển khi tiếp xúc với từ trường nhưng một khi từ trường bị loại bỏ, chúng chỉ duy trì từ tính ở mức tối thiểu. Đặc tính này cho phép các hạt từ tương tác với phân tử đích dựa vào các biến đổi trên bề mặt, chúng sử dụng từ trường ngoài để tập trung nhanh chóng, sau đó tản mát ra xa khi từ trường mất đi. Các mẫu vật được ly giải trong dung dịch chứa chất ức chế RNase và gắn với các hạt từ. Các hạt này cùng với phân tử ARN đích tập hợp lại trong từ trường. Sau một vài lần giải phóng trong dung dịch rửa rồi lại gắn kết với hạt từ, ARN được rửa giải và hạt từ được loại bỏ.

Nguyên tắc chung của phương pháp sử dụng hạt từ (Nguồn: https://advancedbiochemicals.com)
- Ưu điểm
- Nhược điểm
d) Phương pháp ly giải trực tiếp
Ly giải trực tiếp là quá trình chuẩn bị mẫu không có bước tinh sạch. Trong phương pháp này, đệm ly giải được sử dụng để phá hủy mẫu, ổn định các acid nucleid, thích hợp cho các phân tích tiếp theo (downstream). Thông thường, mẫu được trộn cùng các nhân tố ly giải, ủ một thời gian trong những điều kiện xác định, sau đó sử dụng trực tiếp cho các phân tích sau. Nếu cần thiết, mẫu sẽ được tinh sạch khỏi các sản phẩm ly giải ổn định. Quy trình ly giải trực tiếp không bao gồm bước gắn và rửa giải từ bề mặt rắn nên tránh được các yếu tố ảnh hưởng hiệu suất thu hồi như các phương pháp tinh sạch khác.
- Ưu điểm
- Nhược điểm
3. Định lượng ARN tách được
Định lượng ARN là bước quan trọng và cần thiết trước khi tiến hành các phương pháp phân tích ARN. Phần dưới đây sẽ thảo luận về 1 số kỹ thuật định lượng ARN thông dụng và những kinh nghiệm để tối ưu hóa từng phương pháp.
a) Quang phổ UV (UV Spectroscopy)
Phương pháp truyền thống này đánh giá nồng độ và độ tinh sạch ARN. Độ hấp thụ ánh sáng của mẫu ARN pha loãng được đo ở bước sóng 260 và 280 nm. Sử dụng định luật Beer-Lambert để tính toán mật độ ARN:
A = Ecl

Trong đó:
A= độ hấp thụ ánh sáng ở bước sóng nhất định
C = nồng độ acid nucleid
l = chiều dài đường truyền của ánh sáng qua mẫu hay độ dày cuvet (thường là 1 cm)
E = hệ số háp thụ (đối với ARN E= 0,025 (mg/ml)-1cm-1)
Trị số A260 1.0 tương đương ~40 µg/mL ARN sợi đơn. Tỷ số A260/A280 dùng để đánh giá độ tinh sạch của ARN. A260/A280 ~ 1.8 – 2.1 cho thấy ARN đã tinh sạch. Quang phổ UV là phương pháp dễ dàng thực hiện và được sử dụng rộng rãi trong các phòng thí nghiệm để định lượng ARN. Tuy nhiên, có một vài vấn đề cần lưu ý:
Bảng 1. Ảnh hưởng của pH lên tỷ số A260/A280
|
Mẫu Blank |
Tỷ số A260/A280 |
|
Nước xử lý với DEPC (pH 5 - 6 ) |
1.60 |
|
Nước không chứa nuclease (pH 6 - 7) |
1.85 |
|
TE (pH 8.0) |
2.14 |
b) Nhuộm huỳnh quang (Fluorescent Dyes)
Các chất nhuộm huỳnh quang như Quant-iT™ RiboGreen® RNA Reagent phát huỳnh quang mạnh khi gắn với acid nucleid. Chỉ một lượng nhỏ ARN (1 ng/mL) có thể được xác định và định lượng bằng cách sử dụng thuốc thử RiboGreen® với một huỳnh quang kế chuẩn (standard fluorometer), đầu đọc microplate huỳnh quang (fluorescence microplate reader) hoặc huỳnh quang kế màng lọc (filter fluorometer).
Để định lượng chính xác ARN, đồ thị của mẫu chưa biết nồng độ được dựng lên dựa vào đường cong chuẩn xây dựng từ mẫu đã biết nồng độ, thường là dựa trên độ hấp thụ ánh sáng ở 260 nm. Phạm vi tuyến tính của quá trình định lượng bằng RiboGreen® nằm ở khoảng 1 ng/mL tới 1 µg/mL. Ngoài ra, Quant-iT™ RiboGreen® RNA Reagent rất nhạy với các tạp chất không phải acid nucleid, do đó đường tuyến tính được duy trì. Phương pháp định lượng ARN này có thể được tối ưu hóa bằng các cách sau:
c) Công cụ Agilent® 2100 Bioanalyzer™
Agilent® 2100 Bioanalyzer™ là sự kết hợp của kênh dẫn vi lưu (microfluidics), điện di mao quản, và thuốc nhuộm huỳnh quang giúp đánh giá nồng độ và sự nguyên vẹn của ARN. Sau khi gắn mồi Bioanalyzer ™ Lab Chip với ma trận tách, thang chuẩn ARN (RNA Ladder) và các mẫu được nạp vào các giếng trên chip. Thông tin về kích thước và khối lượng được cung cấp bởi huỳnh quang của các phân tử ARN khi chúng di chuyển qua các kênh của chip. Các phần mềm tự động so sánh diện tích đỉnh từ các mẫu ARN chưa biết đến vùng diện tích kết hợp sáu đỉnh Agilent® RNA 6000 Ladder RNA và xác định nồng độ của các mẫu chưa biết đó. Hệ thống Agilent® RNA 6000 Nano có phạm vi hoạt động rộng và có thể định lượng 25-500 ng / ml ARN, trong khi hệ thống Agilent® RNA 6000 Pico Chip có thể định lượng 50-5,000 pg / ml ARN.
Có lẽ tính năng hiệu quả nhất của công cụ Agilent® 2100 Bioanalyzer™ là khả năng cung cấp thông tin về sự nguyên vẹn của ARN. Khi mỗi mẫu ARN được phân tích, phầm mềm tạo ra một hình ảnh giống gel (gel-like image) và một hình ảnh điện di đồ (electropherogram). Khi phân tích ARN tổng số, một thuật toán được sử dụng để đanh giá sự nguyên vẹn của ARN (RNA Integrity Number, hay RIN) với giá trị tối đa là 10. Trị số RIN giảm mạnh cho thấy ARN phân hủy nhiều.
4. Bảo quản ARN
Bước cuối cùng trong quy trình phân tách ARN là tạo lại dịch huyền phù ARN, bảo quản trong môi trường không có RNase ở - 80oC. Một vài dung dịch bảo quản ARN:
Dịch giả Nguyễn Ngọc Nam
Biên soạn BioMedia VN
Quy trình chuẩn bị ARN cho phân tích gồm 4 bước chính: Bước 1: Thu thập và bảo quản mẫu Bước 2: Tách chiết ARN Bước 3: Định lượng...
Các nhà khoa học đã có một phát hiện đột phá trong việc hiểu rõ phương thức mà hệ thống miễn dịch hoạt động để...
Theo một báo cáo nghiên cứu vào ngày 9 tháng 3 trên tạp chí Science Translational Medicine, hai loại phân tử có khả năng khiến cho...